心肌肥厚是导致心力衰竭和心脏性猝死的主要原因之一,OTUD7a是一种去泛素化酶,也是一种潜在的肿瘤抑制因子,此前被证实与神经发育障碍和肿瘤相关,其对心血管疾病尤其是心脏肥大的作用尚未阐明。2025年11月21日,郑州大学第一附属医院王小芳/郑哲团队在Circulation Research (IF 16.2)在线发表文章“OTUD7a Accelerates Pathological Cardiac Hypertrophy via TAK1 Activation”,研究首次证实OTUD7a 是病理性心肌肥厚的新型促进因子,并表明靶向OTUD7a-TAK1轴是治疗心肌肥厚及相关心力衰竭的潜在有效策略。

· 维真助力·
基因信息 OTUD7a:OTU结构域包含蛋白7a
感染细胞 新生大鼠心肌细胞
病毒产品 Ad-OTUD7a
MOI 50
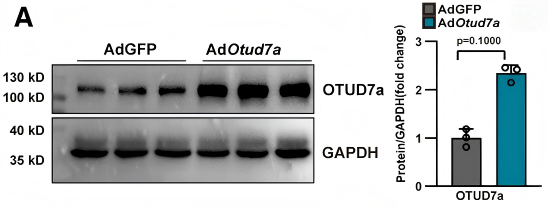
Ad-OTUD7a转导的新生大鼠心肌细胞中OTUD7a成功过表达
研究结果
1、体内外实验证实OTUD7a促进病理性心肌肥厚,调控心脏重塑与心功能
研究结果证实OTUD7a在体内TAC手术和体外苯肾上腺素诱导的心肌肥厚模型中表达上调,全身性敲除OTUD7a可减轻小鼠压力超负荷诱导的心脏功能障碍与结构重塑,RNA测序及基因集富集分析显示OTUD7a调控的基因在纤维化、心脏功能和蛋白质加工通路中富集,提示OTUD7a可能参与这些生物学过程来影响心脏重塑。随后构建OTUD7a杂合敲除小鼠模型,证实杂合敲除OTUD7a减轻了TAC诱导的小鼠心肌重构与心功能障碍。进一步在心肌组织特异性敲除及过表达OTUD7a以确定其在体内心脏重塑和功能障碍中的功能作用,结果显示心肌特异性缺失OTUD7a可减轻小鼠病理性心肌肥厚并改善心功能障碍,过表达OTUD7a则产生相反的结果。体外验证实验中以新生大鼠心肌细胞为研究对象,PE刺激成功构建体外心肌肥厚模型,通过腺病毒实现OTUD7a过表达或沉默,结果表明OTUD7a在体外可调控去氧肾上腺素(PE)诱导的心肌细胞肥厚,过表达OTUD7a促进该病理过程,沉默则抑制。
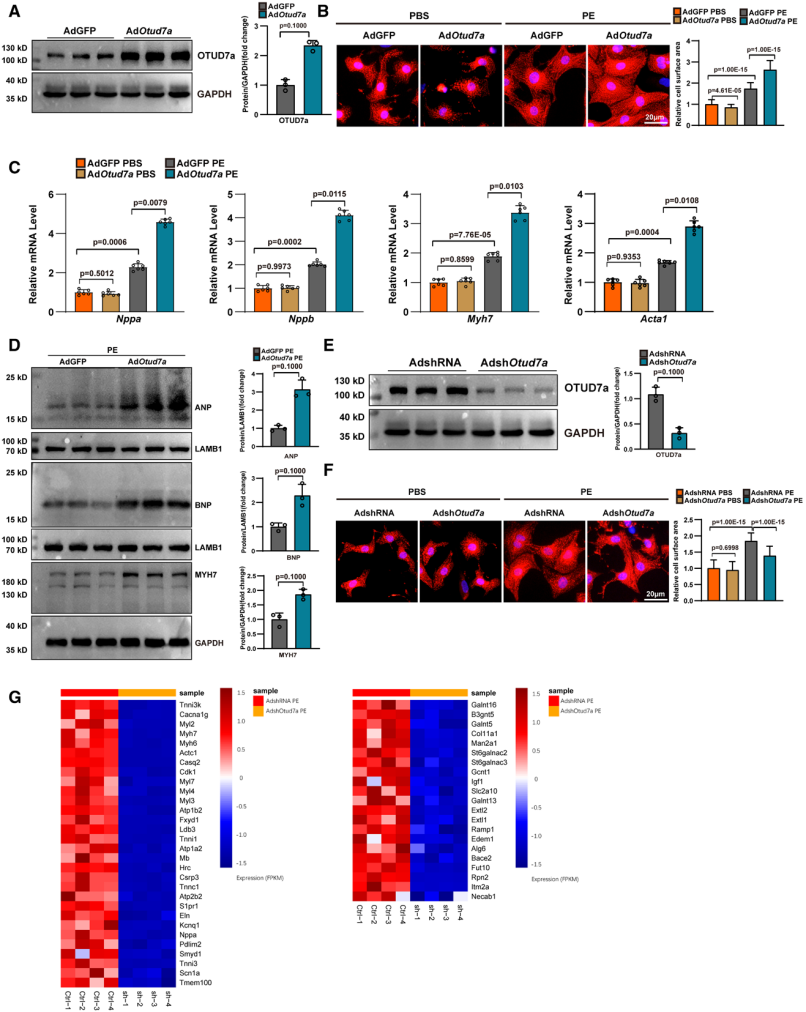
OTUD7a在体外调节去氧肾上腺素诱导的心脏肥大
2、OTUD7a通过靶向激活TAK1-JNK-P38信号通路,调控病理性心肌肥厚
RNA测序及KEGG分析均显示OTUD7a敲除小鼠心脏组织、OTUD7a沉默的心肌细胞中,MAPK信号通路为差异富集最显著的通路,提示OTUD7a与该通路密切相关。与WT-TAC小鼠相比,OTUD7a敲除-TAC小鼠中p-JNK和p-P38的水平下调;与AAV9-GFP-TAC小鼠相比,OTUD7a过表达小鼠中,p-JNK、p-P38水平显著升高;体外验证结果与其一致。体内外分子机制上的探索实验均证实,OTUD7a敲除/沉默可降低TAK1的总蛋白水平及p-TAK1水平;OTUD7a过表达则显著升高TAK1及 p-TAK1水平。这些数据阐明了OTUD7a诱导的恶化的病理性心脏肥大可能依赖于TAK1-JNK-P38通路的激活。TAK1-JNK-P38信号通路的关键分子(TAK1、p-TAK1、p-JNK、p-P38)表达呈时间依赖性激活,且该趋势在体外PE诱导的心肌细胞肥厚模型和体内TAC诱导的小鼠心肌肥厚模型中均一致。进一步使用TAK1抑制剂5Z-7-oxozeaenol可阻断OTUD7a过表达引起的TAK1-JNK/P38通路激活,同时逆转OTUD7a过表达导致的心肌肥厚加重,证实OTUD7a对心肌肥厚的调控依赖TAK1-JNK-P38通路。

OTUD7a可以调节蛋白质加工和MAPK信号传导
3、OTUD7a直接结合TAK1促进心脏肥大
免疫共沉淀实验及GST Pull-down实验证实OTUD7a和TAK1蛋白存在相互作用。接着,研究团队构建了OTUD7a和TAK1的系列截短体,确定了OTUD7a上第201至384位氨基酸组成的结构域与TAK1上第1至390位氨基酸组成的结构域发生结合,且二者共定位在细胞质中。进一步验证发现OTUD7a 突变体无法激活TAK1,也不能促进心肌肥厚,证实OTUD7a对TAK1的调控依赖其完整功能结构域,此外OTUD7a过表达以浓度依赖方式上调 293T 细胞内源性TAK1蛋白水平。在PE刺激的NRCM中加入不同通路抑制剂,发现蛋白酶体抑制剂MG132可逆转OTUD7a沉默引起的TAK1表达降低,而溶酶体抑制剂无挽救作用。为深入阐明OTUD7a稳定TAK1蛋白的机制,研究人员检测了TAK1的泛素化水平,发现OTUD7a表达降低时,TAK1的泛素化水平显著升高;OTUD7a过表达时,TAK1的泛素化水平显著降低。体外泛素化实验结果显示,OTUD7a可对TAK1进行去泛素化修饰。上述研究结果表明TAK1的降解由OTUD7a通过K48连接的泛素化途径介导。

OTUD7a稳定TAK1蛋白
研究结论
综上,本研究首次证实OTUD7a是病理性心肌肥厚的重要致病因子。在心脏应激状态下,OTUD7a直接与TAK1相互作用,抑制TAK1的泛素化降解,进而升高TAK1及其下游JNK/P38的磷酸化水平。OTUD7a通过TAK1-JNK-P38轴调控心肌肥厚的发生发展,这些发现为阐明病理性心肌肥厚的发病机制提供了新视角,并为心肌肥厚的治疗提供了新策略。
